Tilbake til artikkelserien om metabolismen
Kolesterol er en livsviktig forbindelse, og kanskje det ernæringsrelaterte molekylet som er mest debattert. Alle cellene i kroppen vår inneholder kolesterol, og vi finner det både i maten vi spiser og lager det selv i leveren. I denne artikkelen får du en innføring i hvordan kolesterolmolekylet dannes, hva det brukes til og hvordan vi kvitter oss med det.
Les også artikkelen om lipoproteinmetabolismen.
Produksjon av kolesterol
Kolesterol produseres hovedsakelig i leveren, men de fleste andre celler har også kapasitet til å produsere noe selv. Kolesterol produseres i tre faser, og utgangspunktet er tokarbonenheten Acetyl-CoA. Som vi har sett i artiklene om glukose så vi at acetyl-CoA også er utgangspunktet for produksjon av disse vannløselige energimolekylene.
Kolesterol består av 27 karbonatomer, og alle disse kommer fra Acetyl-CoA. Byggestenen i kolesterolsyntesen er en aktivert isoprenenhet som heter isopentenyl pyrofosfat. I det første av de tre syntesefasene produseres denne fra acetyl-CoA. I den neste fasen kobles seks slike enheter sammen og danner squalene. I den siste fasen omdannes squalene til kolesterol. Her kommer en gjennomgang av de tre fasene.
1. Produksjon av isopentenyl pyrofosfat
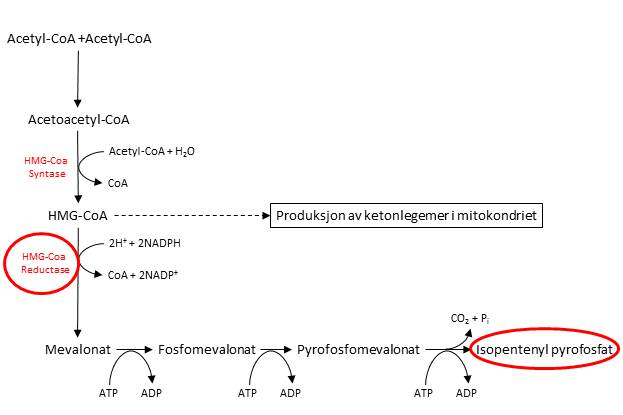
Det første steget i kolesterolsyntesen finner steg i levercellenes cytosol. Det første som skjer i denne prosessen kjenner vi igjen fra ketonmetabolismen, der tre acetyl-CoA går sammen og danner 3-hydroksy-3-metylglutaryl-CoA (HMG-CoA). I ketonmetabolismen så vi at dette kunne metaboliseres videre til ketonlegemet acetoacetat. HMG-CoA kan også brukes til kolesterolsyntese, og det hastighetsregulerende enzymet her er HMG-CoA reduktase, som omdanner HMG-CoA til mevalonat.
I tre energikrevende enzymatiske steg blir mevalonat omdannet til isopentenyl pyrofosfat, som inneholder 5 karbonatomer. Figuren under oppsummerer den første fasen i kolesterolsyntesen.
2. Produksjon av squalene
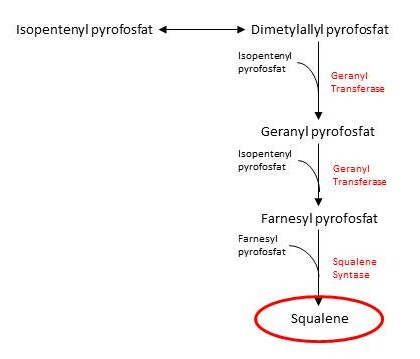
Squalene inneholder 30 karbonatomer, og vi trenger derfor seks isopentenyl pyrofosfat for å lage et squalenemolekyl. Det første som skjer er at isopentenyl pyrofosfat blir isomerisert og det dannes dimetylallyl pyrofosfat. Disse molekylene har begge fem karbonatomer, og disse kobles sammen og danner tikarbonenheten geranyl pyrofosfat. Deretter kobles enda et isopentenyl pyrofosfat til, og vi sitter igjen med farnesyl pyrofosfat, som har 15 karbonatomer. Det er det samme enzymet som katalyserer begge disse kondenseringsreaksjonene, og det heter geranyl transferase.
For å produsere squalene så kobles to farnesyl pyrofosfat sammen, i en reaksjon katalysert av squalene syntase. Figuren under oppsummerer den andre fasen i kolesterolsyntesen.
3. Kolesterolproduksjon
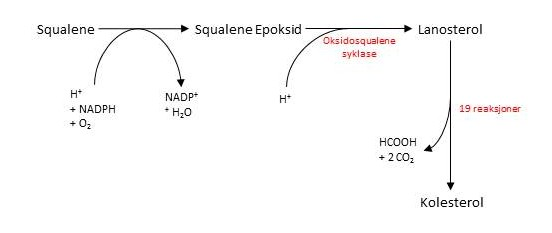
I den siste fasen får vi dannet kolesterol fra squalene. Først må squalene aktiveres ved å omdannes til squalene epoksid (2,3-oksidosqualene). Oksidosqualene syklase katalyserer omdanning av oksidosqualene til lanosterol, og ved fjerning av tre metylgrupper får vi til slutt dannet det ferdige kolesterolmolekylet. Dette skjer over en rekke på 19 enzymatiske reaksjoner. Figuren under oppsummerer den siste fasen.
Regulering av kolesterolsyntesen
Kolesterol er et livsnødvendig molekyl, og vi kan i tillegg til å produsere det selv også få det fra kostholdet. For at kolesterolmengdene skal være under en viss kontroll så reguleres syntesen blant annet i forhold til hvor mye som tilføres gjennom maten vi spiser.
Den intracellulære konsentrasjonen av kolesterol fungerer som en viktig feedbackmekanisme, og denne virker først og fremst inn på det hastighetsregulerende enzymet i kolesterolsyntesen, HMG-CoA reduktase. Dette enzymet kontrolleres på gennivå av sterol reguleringselementbindende protein (SREBP), som binder til DNA og øker transkripsjonen av HMG-CoA reduktase-proteinet. Når mengden kolesterol i cellen synker så binder SREBP i større grad til DNA, og da øker kolesterolsyntesen. Det motsatte skjer når kolesterolmengden inne i cellen øker. Produksjonen av HMG-CoA hemmes også av sine egne metabolitter.
Økte konsentrasjoner av kolesterol i cellen vil også øke nedbrytningen av HMG-CoA reduktase, som også er med å regulere aktiviteten til enzymet. Mengden kolesterol og andre metabolitter i cellen regulerer altså både transkripsjon og translasjon av HMG-CoA reduktase så vel som nedbrytning av enzymet. HMG-CoA reduktase reguleres også hormonelt. Insulin stimulerer mens glukagon og adrenalin hemmer enzymet.
Kostholdet kan også påvirke kolesterolsyntesen. Økt inntak av kolesterol fra maten kan midlertidig øke mengden kolesterol, men dette vil som nevnt over føre til at egenproduksjonen reduseres. Mye mettet fett i kostholdet kan gi økt mengde substrat (Acetyl-CoA) for kolesterolsyntese som følge av økt nedbrytning av disse fettsyrene i leveren og derfor også kan bidra til økt syntese. I tillegg vil økt konsentrasjon av fritt kolesterol i leveren gjøre at den i mindre grad tar opp kolesterol fra blodet, slik at blodnivåene øker. Man har sett at mettet fett kan hindre esterifiseringen av kolesterol og dermed øke mengden fritt kolesterol. Flerumettet fett er satt i forbindelse med redusert kolesterolnivå, men mekanismene for dette er ikke kjent. Dette påvirkes også av det totale kostholdet, og den sterkeste pådriveren for økt kolesterolsyntese er et spisemønster som fører til overvekt.
Statiner er kolesterolsenkende medikamenter som virker ved å hemme det hastighetsregulerende enzymet HMG-CoA reduktase.
Funksjoner
Kolesterol er en bestanddel i alle cellemembranene våre, og er med å justere fluiditeten i disse. Dette påvirker blant annet hvor lett andre molekyler passerer gjennom membranen. Mer kolesterol gjør membranen mer rigid, mens en lavere mengde kolesterol gjør membranen mer flytende. Kolesterol er også en viktig byggestein for en lang rekke molekyler.
Utenom å inngå i cellemembraner er den største oppgaven å være substrat for gallesaltene, noe omtrent 80% av kolesterolet brukes til. Disse produseres i leveren og er viktige for fordøyelsen av fett. Etter fettabsorbsjonen i tarmen kan gallesaltene reabsorberes og brukes på nytt. Dette er imidlertid også den primære veien vi kvitter oss med kolesterol, da ikke alle gallesaltene blir reabsorbert. Når vi spiser fiber så kan dette binde seg til gallesalter og hindre reabsorbsjon Dette er mekanismen som ligger til grunn for at fiber har en kolesterolsenkende effekt, da dette medfører at mer kolesterol må brukes til å produsere nye gallesalter.
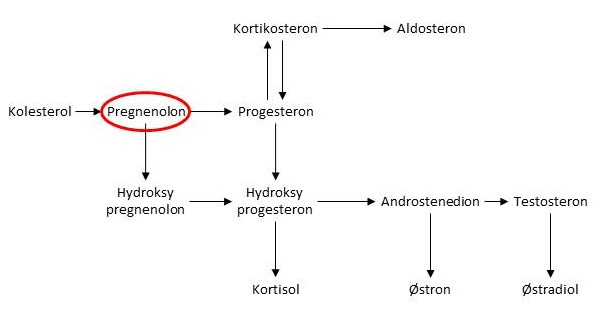
Kolesterol er også byggestein for steroidhormonene våre, deriblant kjønnshormonene testosteron og østrogen. Glukokortikoider og mineralokortikoider, som er med å regulere prosesser som energimetabolisme og blodtrykk, er andre eksempler på steroidhormoner som produseres fra kolesterol. Siden steroidhormonene inneholder færre karbonatomer enn kolesterolmolekylet er det første steget å fjerne seks karbonatomer og danne en forbindelse som heter pregnenolon. Det er deretter pregnenolon som er forløper for alle disse hormonene. Figuren under viser en oversikt over hvordan de ulike steroidhormonene produseres fra pregnenolon.
Når vi danner nytt D-vitamin i huden som følge av soleksponering så er en kolesterolforbindelse, 7-dehydrokolesterol, utgangspunktet for denne syntesen.
Kolesterol er en viktig bestanddel av lipoproteinene, som er ansvarlig for å frakte fettløselige forbindelser i blodet. Når vi snakker om bra og dårlig kolesterol så er det egentlig de ulike lipoproteinene det er snakk om, da molekylet kolesterol er det samme i alle tilfeller. De ulike lipoproteinene og deres metabolisme kommer jeg tilbake til i en egen artikkel.
Artikkelen er sist oppdatert oktober 2013